シャッター速度世界一の超解像蛍光顕微鏡理化学研究所 生命システム研究センター 細胞動態計測コア 細胞極性統御研究チーム チームリーダー 岡田 康志
- 説明文
- 写真
可視光を用いた光学顕微鏡の分解能は回折により制限され,200nm程度が限界であると強く信じられていたが,2000年頃から蛍光分子の性質を巧みに利用することで回折限界を超えた分解能を達成する超解像蛍光顕微鏡法の研究・開発が盛んになり,2014年にはノーベル化学賞が授与された。
私たちは,超解像蛍光顕微鏡を細胞内小器官など細胞内微細構造の観察に応用してきた。しかし,既存の超解像蛍光顕微鏡法はいずれも時間分解能を犠牲にしており,1枚の超解像画像を撮影するのに数秒から数分もの撮影時間を要するため,生きた細胞の観察には不適であった。数μm/sの速度で動き回る細胞内小器官をシャープに撮影するためには,1コマ10ミリ秒程度の高速撮影が必須である。これに加えて,回折限界を超える空間解像度(たとえば100nm程度)や細胞全体を見ることが出来る十分広い視野(たとえば100μm四方)も欠かせない。
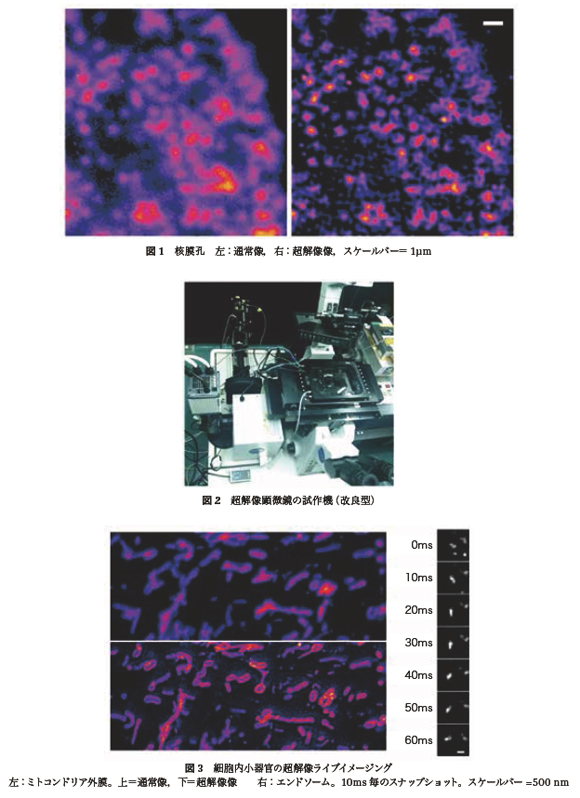
しかし,この3つの条件を全て満たすことが可能な顕微鏡は存在しておらず,私たちは独自開発に着手した。理論的考察により,既存のスピニングディスク式共焦点顕微鏡法に改造を加えることで上記条件が達成可能であると示唆された。こうして作成した試作機で2012年末に除夜の鐘を聞きながら撮影したのが図1である。核膜孔という細胞核表面に多数散在する微細構造を観察している。単にシャープに見えるだけでなく,一部の核膜孔で中央部が黒く抜けて見える。実は,核膜孔は,その名の通り中央に直径約100nmの孔がある。この,回折限界以下で光学顕微鏡では観察不可能な孔が見えたのである。私たちの顕微鏡の分解能が,回折限界を超えて100nm程度まで伸びていると示された瞬間である。
その後,試作機を改良して(図2)世界一の時間分解能10ms/コマが達成され,細胞内のエネルギー供給工場であるミトコンドリアの動態や,細胞内のリサイクル工場であるエンドソームの高速仕分け現場などが初めて観察可能となった(図3)。本顕微鏡法は,既存の共焦点顕微鏡に多少の改造を加えるだけで実装できるため,細胞生物学の様々な分野で応用が拡がるものと期待される。
私たちは,超解像蛍光顕微鏡を細胞内小器官など細胞内微細構造の観察に応用してきた。しかし,既存の超解像蛍光顕微鏡法はいずれも時間分解能を犠牲にしており,1枚の超解像画像を撮影するのに数秒から数分もの撮影時間を要するため,生きた細胞の観察には不適であった。数μm/sの速度で動き回る細胞内小器官をシャープに撮影するためには,1コマ10ミリ秒程度の高速撮影が必須である。これに加えて,回折限界を超える空間解像度(たとえば100nm程度)や細胞全体を見ることが出来る十分広い視野(たとえば100μm四方)も欠かせない。
しかし,この3つの条件を全て満たすことが可能な顕微鏡は存在しておらず,私たちは独自開発に着手した。理論的考察により,既存のスピニングディスク式共焦点顕微鏡法に改造を加えることで上記条件が達成可能であると示唆された。こうして作成した試作機で2012年末に除夜の鐘を聞きながら撮影したのが図1である。核膜孔という細胞核表面に多数散在する微細構造を観察している。単にシャープに見えるだけでなく,一部の核膜孔で中央部が黒く抜けて見える。実は,核膜孔は,その名の通り中央に直径約100nmの孔がある。この,回折限界以下で光学顕微鏡では観察不可能な孔が見えたのである。私たちの顕微鏡の分解能が,回折限界を超えて100nm程度まで伸びていると示された瞬間である。
その後,試作機を改良して(図2)世界一の時間分解能10ms/コマが達成され,細胞内のエネルギー供給工場であるミトコンドリアの動態や,細胞内のリサイクル工場であるエンドソームの高速仕分け現場などが初めて観察可能となった(図3)。本顕微鏡法は,既存の共焦点顕微鏡に多少の改造を加えるだけで実装できるため,細胞生物学の様々な分野で応用が拡がるものと期待される。
参考文献
- S. Hayashi, and Y. Okada: “Ultrafast superresolution fluorescence imaging with spinning disk confocal microscope optics,” Mol Biol Cell., Vol 26, No 9, pp1743-51(2015)




















![研究室探訪vol.30 [奈良先端科学技術大学院大学 サイバネティクス・リアリティ工学研究室]](https://www.adcom-media.co.jp/wp-content/themes/adcom/scripts/timthumb.php?src=/wp-content/uploads/2022/11/laboratory1.jpg&w=80&h=100&zc=1&q=100)